酪酰胺信号放大(TSA,Tyramide signal amplification)技术是一类利用辣根过氧化酶(HRP)对靶蛋白或核酸进行高密度原位标记的酶学检测方法。该技术可与高性能染料Alexa Fluor®、传统荧光染料和比色检测系统相兼容。通过使用TSA技术可以检测到传统方法无法检出的低丰度靶标。基于酪酰胺的信号放大技术能够在无需牺牲分辨率的条件下提供前所未有的敏感度。仅需一个简单的孵育步骤对样本进行处理,即可获得样本的多色标记信号;同时,该技术可与其他信号放大系统或传统标记方法联合使用,用于共定位的相关研究。
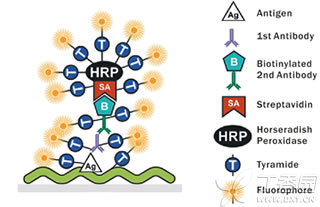
TSA主要原理是利用酪胺Tyramide的过氧化物酶反应(酪胺盐在HRP催化H202下形成共价键结合位点),产生大量的酶促产物,该产物能与周围的蛋白残基(包括色氨酸、组氨酸和酪氨酸残基)结合,这样在抗原-抗体结合部位就有大量的生物素沉积,与随后加入的Streptavidin—HRP/荧光基团结合,经几次这样的循环放大,可以结合大量的酶分子or荧光基团,结果使其检测信号得到几何级放大。
简单来说,用这种方法做多重免疫荧光是利用二抗上带有的HRP(而不是直接偶联荧光素),来催化后续添加入体系的非活性荧光素。荧光素在HRP和过氧化氢的作用下被活化,跟临近蛋白的酪氨酸残基共价偶联,使得蛋白样品与荧光素稳定结合。
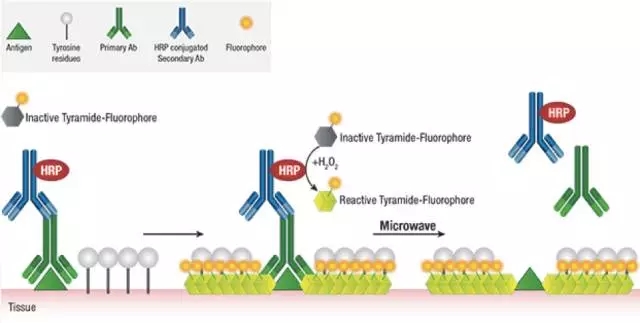
然后微波处理,前一轮非共价结合的抗体被洗掉,共价结合的荧光素还留存在样品上。再换个一抗来第二轮孵育,周而复始。等到所有抗体孵育结束,荧光素都结合好后,最后去检测结果。
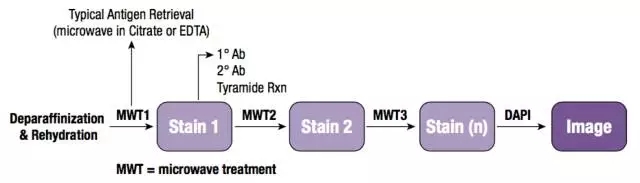
由于每次体系中都只有单一抗体孵育,因此无需担心抗体交叉反应,以及一抗二抗种属匹配问题,大大减少了实验设计时不同种属抗体选择匹配的限制。
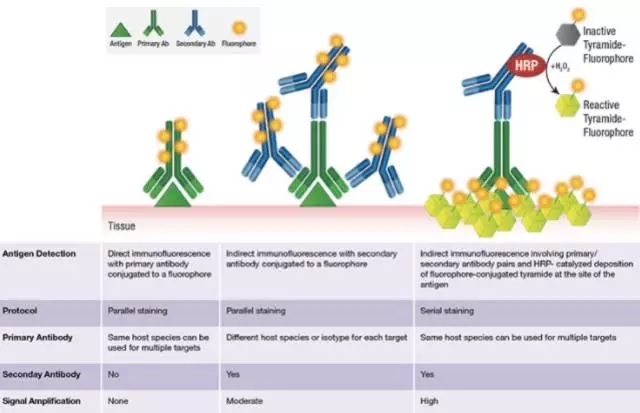
也就是说,如果用TSA技术,同一张片子上所有的靶标都可以选用特异性高的兔单克隆抗体。搭配同一支抗兔的HRP二抗就可以进行实验,而且信号放大的倍数大大增强。
TSA技术可以用于检测用传统方法无法检出的低丰度靶标。基于酪酰胺的信号放大技术能够提供极强的敏感度、检测极微量的目的抗原。极大的降低抗体的用量,节约抗体,实测确实可以显著提升抗体的稀释比例。有厂家宣称在保证结果下可以降低抗体的1000倍的使用量。简单的孵育步骤对样本进行处理,即可获得样本的多色标记信号,对于不同类型抗原进行检测,如核酸及蛋白的同时标记检测;同时,该技术可与其他信号放大系统或传统标记方法联合使用。同一来源种属抗体的多重标记免疫组化实验,利用检测试剂的敏感性差异可以完成多重荧光标记。
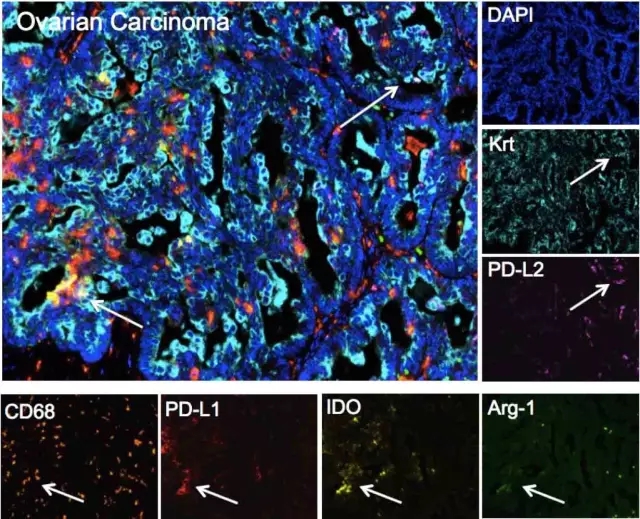
荧光法多重免疫组化,可同时进行五个颜色通道以上,这种情况下发射光谱会重叠,我们可以借助多光谱成像系统来解决这个问题。这是传统间接荧光法染色和显色法多重免疫组化所做不到的。这种方法能真实反映关键蛋白的表达情况和相互之间的关系,从而极大地节约珍贵的样品。
使用TSA技术,你需要准备:
1、严格验证的高特异性抗体:所有CST的IHC-P验证过的抗体都满足mIHC(多重荧光免疫组化)高特异性的要求
2、HRP偶联的针对一抗种属亚型特异的二抗
3、酪胺荧光素(PerkinElmer, Thermo Fisher Scientific等供应商)
4、多光谱成像系统(PerkinElmer等)
CST抗体做mIHC的通用实验方案及实验优化原则
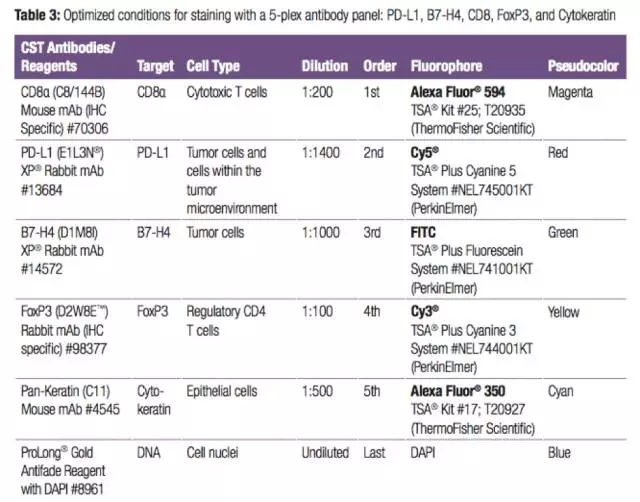
CST利用mIHC检测肿瘤免疫检查点的应用手册

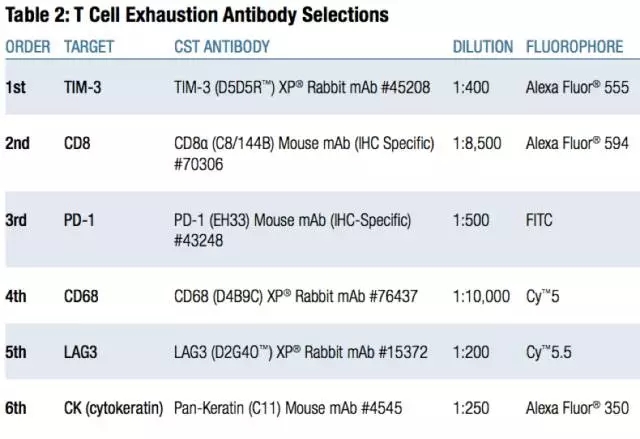
CST已经推出了适用于mIHC小包装抗体试剂盒,性价比高,大家可以直接购买尝试:










