从2011年起,肿瘤免疫疗法逐渐成为继肿瘤手术、放疗、化疗、靶向治疗后的最有希望能成功治愈癌症的手段,如肿瘤免疫检查点抑制剂Keytruda(阻断PD-1)已获批一线治疗非小细胞肺癌, CAR-T细胞疗法成功治疗晚期淋巴细胞白血病等。然而单纯采用肿瘤免疫治疗还存在不足,如PD-1/PD-L1抑制剂目前的总体应答率只有20-30%,CAR-T细胞疗法在实体瘤治疗方面还有待进一步改善。
最近,Annual Review of Cancer Biology上发表了一篇综述,就有关免疫检查点疗法存在的问题进行了探讨,现选译如下:
肿瘤免疫疗法最近几年引发兴趣,一些实体瘤患者采用免疫疗法如T细胞治疗或者T细胞检查点拮抗剂后,获得了持续的缓解。T细胞检查点拮抗剂即中和抗体,其靶蛋白是针对T细胞膜上的两个受体CTLA-4、PD-1以及PD-1的配体(PD-L1)。
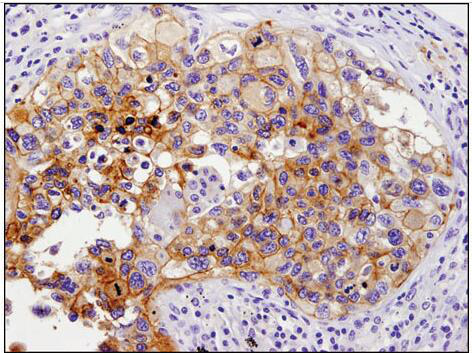
图:使用CST公司的 PD-L1 (E1L3N®) XP® Rabbit mAb(#13684)检测人肺癌石蜡组织切片
CTLA-4与CD28共同享有B7分子配体,但和CD28能活化T细胞不同的是,CTLA-4与B7分子结合后诱导T细胞无反应性,抑制IL-2的产生,参与免疫反应的负调节。
现在发现,CTLA-4能活化T细胞的Hippo通路,导致Blimp-1的表达。Blimp-1是一种转录抑制因子,促使T细胞的分化和抑制IL-2的表达。CTLA-4还上调调节性T细胞的功能。因此,CTLA-4的抗体能间接干扰调节性T细胞的免疫抑制功能,或直接把肿瘤微环境中的调节性T细胞清除掉。PD-1也参与TCR通路的抑制。CTLA-4或PD-1基因敲除的小鼠会产生自身免疫病。T细胞的其他抑制性受体还包括LAG-1、TIM-3和BTLA4,也显示良好的治疗前景。
最近应用PD-1和PD-L1抗体对于黑色素瘤和肺癌的研究显示,疗效不佳的患者其肿瘤内的T细胞均较少。这可能源于两个原因。一个原因是那些肿瘤的免疫原性不强。只有那些发生错配修复缺失导致的微卫星不稳定的肿瘤细胞才有T细胞围绕在肿瘤细胞周围,因为有异常抗原的呈递,这时PD-1治疗的效果才较好。对其他肿瘤也发现,非同义突变的频率与T细胞检查点拮抗剂的疗效成正相关。

图:使用PD-L1,CD3ε和CD8α多重免疫组化抗体套装(#65713)检测人乳腺癌组织石蜡切片
但研究又显示,在错配修复异常的10例结直肠癌的患者中,只有4例对PD-1抗体的治疗有效,提示肿瘤微环境中还存在某类细胞产生免疫抑制,导致肿瘤特异性T细胞不能集聚在肿瘤细胞周围。
肿瘤免疫分为两个阶段:一是肿瘤细胞的识别,使得CD4
+和CD8
+T细胞激活进入引流淋巴结。二是肿瘤内的T细胞扩增。这两个阶段都依赖于一种DC细胞亚群,名为CD8
+/CD103
+DC细胞。淋巴组织内的CD8
+DC细胞和非淋巴组织内的CD103
+DC细胞均能呈递抗原给CD8+T细胞,使之活化和扩增。而这些DC细胞要迁移到肿瘤内,I型干扰素诱导单核细胞表达趋化因子CXCL10 和CXCL11至为关键。CD8
+/CD103
+DC细胞表达这2个趋化因子的受体CXCR3,从而迁移集聚到肿瘤内。
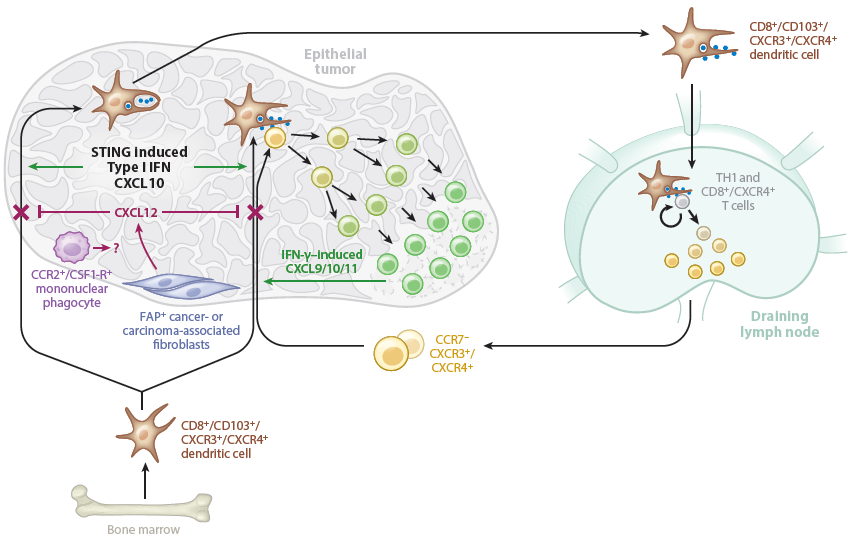
肿瘤内的CD8
+/CD103
+DC细胞在抗原加工后,再迁移至引流淋巴结,激活CD4
+和CD8
+的肿瘤特异T细胞,使之能不断的自我更新复制,并产生出能定居在肿瘤内的效应T细胞。这一步也涉及IFN诱导的趋化因子CXCL9、CXCL10和CXCL11以及Th1细胞、CD8
+T细胞、CD8
+/CD103
+DC细胞表达CXCR3受体。
肿瘤特异的CD8+T细胞可在肿瘤内不断扩增。肿瘤内的CD8a
+/CD103
+ DCs 细胞达到一定数量时,其与肿瘤特异的T细胞达到充分的相互作用,就能产生杀死癌细胞的肿瘤内CD8
+T细胞。研究显示,一些肿瘤内缺乏CD8a
+/CD103
+ DCs 细胞,这一点成为不能有效产生肿瘤免疫的关键。
肿瘤微环境中有三种已报道能抑制免疫的基质细胞,分别为肿瘤相关的成纤维细胞(CAF)、内皮细胞和粒单核细胞。粒单核细胞群体最杂,包含粒细胞源性的抑制细胞(MDSCs)和炎症单核细胞。这里不讨论其他具有免疫抑制活性的淋巴细胞,如NK T细胞和表达Foxp3的调节性T细胞。这里也不讨论肿瘤微环境的其他免疫抑制机制,如环氧合酶、IDO等。
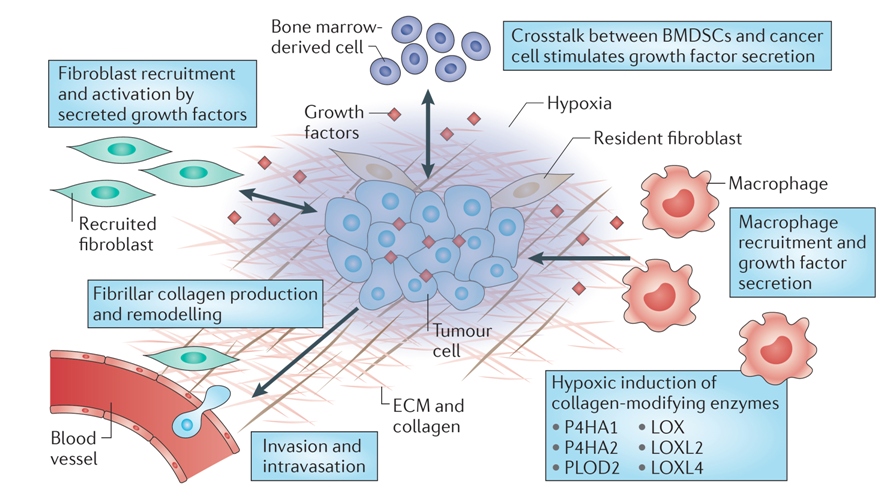
1、CAF
有四项研究观察了CAF清除后对肿瘤生长的影响。其中两项研究显示,在所有人的腺癌中,活化的成纤维细胞都表达一种膜蛋白FAP,另两项在小鼠肺癌和胰导管癌模型中研究中,发现FAP
+细胞表达α-SMA,细胞被鉴定为肌成纤维细胞。将FAP
+细胞清除后,肿瘤生长得到控制,这一效应是T细胞介导的,并且肿瘤对PD-L1抗体治疗更为敏感。
FAP
+的癌相关成纤维细胞产生免疫抑制的潜在机理如下:FAP蛋白是一种二肽基肽酶,抑制FAP后可减缓肿瘤生长和增加肿瘤内T细胞的集聚,推测FAP可能抑制CXCL10。另一机制是,FAP
+细胞分泌CXCL12。CXCL12将T细胞排斥在肿瘤区域之外。CXCL12的受体CXCR4在所有免疫细胞中都表达。用CXCR4的小分子抑制剂AMD3100/plerixafor,可增加胰导管癌小鼠对PD-L1抗体的敏感性。
2、MDSCs
MDSCs包括单核细胞和中性粒细胞。用Gr-1抗体去除粒单核细胞后可免疫性控制小鼠模型中的肿瘤生长。该抗体和Ly6c和Ly6g结合。Ly6c和ly6g分别和CD11b一起是单核和中性粒细胞的特有抗原。体内实验发现,耗竭这些细胞可使肿瘤内T细胞集聚,而Gr-1表达的粒细胞却可促进肿瘤生长。
MDSCs产生的免疫抑制通常认为是由精氨酸酶I、iNOS、活性氧、过氧亚硝酸盐介导的。但它们也许是免疫抑制的结果,而非原因。最近一项研究显示,缺氧可促进免疫抑制,肿瘤微环境中的低氧与MDSCs、巨噬细胞和DC细胞的PD-L1上调有关,它是HIF-1α依赖性的。
肿瘤微环境含有许多骨髓来源的单核细胞,它们表达CCR2,可能因肿瘤内的趋化因子CCL2所集聚。这些炎性单核细胞可发育成熟为肿瘤相关的巨噬细胞,并且在功能上可分为M1和M2型,前者抑瘤,后者促瘤,对肿瘤的血管生成、细胞分裂和转移产生影响。这些巨噬细胞的清除,会增加CD8
+T细胞向瘤内的迁入,并控制肿瘤生长。这提示出这些巨噬细胞与阻挡CD8
+T细胞的瘤内迁入有关。
研究还显示,阻断这些单核巨噬细胞的CSFR信号通路,会增加CD8+T细胞在肿瘤内的集聚,增加小鼠胰导管癌模型中肿瘤对CTLA-4抗体和PD-1抗体的疗效。这些巨噬细胞介导的免疫抑制可能是通过分泌IL-10和抑制IL-12的合成来实现的。
抑制这些炎性单核细胞还有一个途径是阻断Btk激酶活性。Ibrutinib,是一种选择性Btk激酶抑制剂,可促进小鼠结肠癌和乳腺癌的免疫控制,增强PD-L1抗体的疗效。B细胞中也表达Btk,ibrutinib可干扰肿瘤相关巨噬细胞和B细胞的相互作用造成的免疫抑制。但该阻断剂也存在潜在的问题,因为Btk也参与I型干扰素的合成,抑制Btk可能也会削弱机体自身对肿瘤的免疫反应。
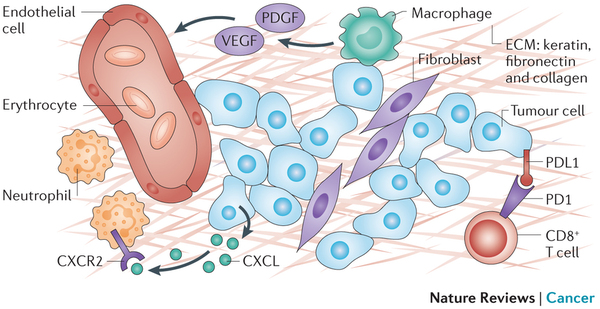
总而言之,如果肿瘤内T细胞的扩增受到抑制这一前提是肿瘤免疫逃逸的基础,那么干扰素诱导的趋化因子CXCL9、CXCL10和CXCL11以及它们共同的受体CXCR3的功能与表达就与之相关。有三种参与肿瘤免疫控制的细胞都表达CXCR3,即TH1 细胞, CD8
+T细胞,CD8
+/CD103
+DC细胞。在TCR刺激下,这些T细胞产生γ干扰素。DC细胞除了抗原呈递外,在γ干扰素刺激下产生CXCL9。CXCL9和CXCL10水平与肿瘤内T细胞的出现频率呈正相关。鉴于粒单核细胞和FAP
+CAF在肿瘤微环境中对肿瘤的保护效应,研究人员应去阐明它们的分子机制,这可能对今后新疗法的产生带来机会。
参考文献:
Douglas T. Fearon.
Annu. Rev. Cancer Biol. 2017. 1:13.1–13.15
相关产品
|
品牌 |
货号 |
名称 |
种属 |
应用 |
|
CST |
14969 |
CXCL10 (D5L5L) Rabbit mAb |
H |
W |
|
CST |
97680 |
CXCR4 (D4Z7W) Rabbit mAb |
H |
IHC-P F |
|
CST |
12199 |
CCR2 (D14H7) Rabbit mAb |
H |
W IP |
|
CST |
85336 |
CD8α (D8A8Y) Rabbit mAb |
H |
W IP IHC-P F |
|
CST |
98941 |
CD8α(D4W2Z) XP® Rabbit mAb (Mouse Specific) |
M |
W IHC-P |
|
CST |
15119 |
CTLA-4 (D4E9I) Rabbit mAb |
H |
F |
|
CST |
8547 |
Btk (D3H5) Rabbit mAb |
H M |
W IP IHC-P F |
|
CST |
8455 |
IFN-γ(D3H2) XP® Rabbit mAb |
H |
W IP F IF-IC |
|
MCE |
HY-10046 |
Plerixafor(趋化因子受体拮抗剂) |
|
对CXCR4和CXCL12介导的趋化性IC50分别为44 nM和5.7 nM |
|
MCE |
HY-10997 |
PCI-32765(Ibrutinib) |
|
Btk选择性抑制剂 |





